JOHNDALTON |
Fue un naturalista, químico, matemático y meteorólogo británico. Entre sus trabajos destacan el modelo atómico y su tabla de pesos relativos de los elementos, que contribuyeron a sentar las bases de la química moderna.
También es conocido por haber descrito el daltonismo, defecto visual relativo a la percepción de los colores que padecía y que lleva su nombre.
PRINCIPIOS DE LA TEORÍA DE DALTON:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa e iguales propiedades. Los átomos de diferentes elementos tienen masa diferente. Comparando la masa de los elementos con los del hidrógeno tomado como la unidad, propuso el concepto de peso atómico relativo.Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos, guardan relaciones simples de números enteros y pequeños.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos.
- Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones. Por ejemplo: todos los átomos de hidrógeno son iguales.
- Por otro lado, los átomos de elementos diferentes son diferentes. Por ejemplo: los átomos de oxígeno son diferentes a los átomos de hidrógeno.
- Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo: los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculasde agua.
- Los átomos se combinan para formar compuestos en relaciones numéricas simples. Por ejemplo: al formarse agua, la relación es de 2 a 1 (dos átomos de hidrógeno con un átomo de oxígeno).
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Por ejemplo: un átomo de carbono con uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman dióxido de carbono (CO2).
IMPORTANCIA
La importancia del modelo atómico de Dalton radica en que permitió aclarar por qué las sustancias químicas podían reaccionar en proporciones estequiométricas fijas, lo que en la actualidad conocemos como la Ley de las proporciones constantes, y nos permitió conocer el por qué cuando dos sustancias reaccionan para formar dos o más compuestos desiguales, las proporciones de estas relaciones son números enteros, supuesto que conocemos con el nombre de la Ley de las proporciones múltiples. Además, nos enseñó que la unidad básica de la materia es el átomo.CONSISTE EN:
El Modelo Atómico de Dalton (1803) es el primer modelo atómico, según el cual se postula que:- La materia está formada por partículas indivisibles, indestructibles y extremadamente pequeñas llamadas átomos
- Los átomos de un mismo elemento son idénticos entre sí (igual masa y propiedades)
- Los átomos de elementos distintos tienen diferente masa y propiedades
- Los compuestos están formados por la unión de átomos en proporciones constantes y simples
EJEMPLOS:
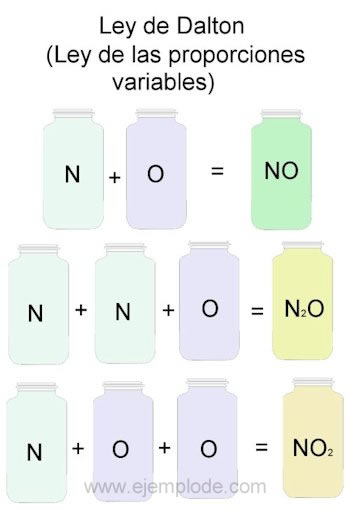
Para ejemplificar la Ley de Dalton, tomaremos como referencia las combinaciones de Nitrógeno (N) y oxígeno (O).
1.Cuando se combinan en la misma proporción, es decir, uno a uno, obtendremos óxido ítrico:
N + O —> NO
N + 2O —> NO2
2N + O —> N2O

No hay comentarios:
Publicar un comentario